Autor: Luis Eduardo Hernández
Tiempo lectura: 8 mins
Conteo: 2029
Si aún no han leído las dos primeras entradas en esta trilogía acerca de las fuerzas intermoleculares, tal vez quieran darles un vistazo en este enlace: parte 1 y en este otro enlace: parte 2. A ver, una sustancia para que pueda tener estados de agregación tiene que tener interacción entre las moléculas. Al decir estado de agregación me refiero a los estados de la materia: sólido, líquido, gas, plasma. Cada estado de agregación a nivel macroscópico depende de la temperatura. Podemos empezar con una temperatura muy baja, digamos 0 K (-273.15 °C, el cero absoluto el cual es imposible llegar sin embargo si es posible llegar muy cerca a él) y en esta temperatura TODA sustancia es sólida. Si empezamos a aumentar la temperatura lentamente, los átomos y/o moléculas empiezan a ganar velocidad y entre más velocidad ganan, las fuerzas que sostienen a las moléculas en estado sólido empiezan a ceder y pasamos del estado sólido (solidísimo) al estado líquido. Aquellas sustancias con fuerzas intermoleculares más débiles, alcanzan este estado de movimiento líquido mucho más rápido que aquellas sustancias con fuerzas intermoleculares más altas. Por eso encontramos que el hidrógeno molecular (P. Fus.: 14 K, -259.16 °C), el helio (P. Fus.: 0.95 K, -272.20 °C) y el nitrógeno molecular (P. Fus.: 63.15 K, -210 °C) tienen puntos de fusión muy bajos: las fuerzas intermoleculares entre sus moléculas son muy débiles (Fuerzas de Dispersión de London). Si seguimos subiendo la temperatura empezamos a derretir otras sustancias que pueden tener fuerzas intermoleculares más fuertes o tamaños más grandes como ocurre con el metano (P. Fus.: 90,7 K, -182.5 °C), etano (P. Fus.: 90.4 K, -182,8 °C) o el éter etílico (P. Fus.: 156,8 K, -116,3 °C). A estas temperaturas, helio, hidrógeno y nitrógeno ya son gases, es decir, ya vencieron aún más las fuerzas intermoleculares y lograron ganar velocidad para poder estar en fase gaseosa.
Continuando con el aumento de temperatura, las moléculas con mayores fuerzas intermoleculares como aquellas que tienen dipolos empiezan a ganar velocidad tal que logran vencer las fuerzas dipolares y pasan del estado sólido al estado líquido. Un ejemplo de sustancias polares son la acetona (P. Fus.: 178,5 K, -94,7 °C), formaldehído (P. Fus.: 181 K, -92 °C) o el formiato de metilo (P. Fus.: 173 K, -100 °C). Subiendo un poco la temperatura, llegamos a vencer las fuerzas intermoleculares llamadas puentes de hidrógeno las cuales son un tipo muy especial de interacción dipolar. Aquí podemos encontrar al metanol (P. Fus.: 175,6 K, -97,6 °C), etilenglicol (P. Fus.: 260,2 K, -13 °C) y el agua (P. fus: 273.15 K, 0 °C). Por último, si seguimos subiendo la temperatura, podemos vencer las fuerzas de los iones, como ejemplo el acetato de sodio (P. Fus.: 597 K, 324 °C), el cloruro de sodio (P. Fus.: 1 074 K, 801 °C) y el óxido de hierro (III)(P. Fus.: 1 812 K, 1 540 °C).
Bien, como pueden ver, a medida que aumentamos temperaturas vamos venciendo fuerzas intermoleculares, lo mismo ocurre cuando pasamos del estado líquido al estado gaseoso, una hermosa correlación ocurre entre las fuerzas intermoleculares y los puntos de ebullición.
¿Y cuándo hablamos de solubilidad? ¿Cuánta sal hay en los océanos? ¿Y por qué no se ve cuando ponemos agua de mar en un recipiente? ¿Cómo es que la sal se disuelve en el agua hasta el punto que no se ve? Tomen agua y agréguenle sal, agiten, se disuelve, vuelvan a agregar sal, agiten, se disuelve; vuelvan a agregar sal… Así y varias veces, el sólido se disuelve y desaparece en el líquido. Lavoisier dijo: «La materia no se crea ni se destruye, solo se transforma» entonces, la sal no desaparece, se disuelve en el agua… Duh!
Si, estoy siendo un poco obvio… Todo para preguntarles: ¿Cómo? ¿Cómo ocurre que la sal se disuelve en el agua? Primero un poquititito de termodinámica. Cuando algo ocurre espontáneamente es porque el sistema que se estudia tiene capacidad energética para llevar dicho proceso a cabo de tal forma que ahora se ubique en un estado más favorable energéticamente. Es decir, si la sal se disuelve en agua espontáneamente es porque este sistema (la sal disuelta en el agua) tiene menos energía que la sal por un lado y el agua por el otro. Cuando decimos «energéticamente favorable» nos referimos a que alcanzó un menor estado de energía. Esta capacidad energética se llama Energía Libre de Gibbs y se representa como ΔG. Se habla de «el cambio de energía libre» cuando nos referimos a esta magnitud. Por lo general, si ΔG tiene signo positivo, el proceso NO ocurre espontáneamente; si el ΔG tiene valor negativo, el proceso SI ocurre, es espontáneo, ocurre sin que le metan energía de ningún tipo.
Esta Energía Libre de Gibbs, ΔG, muestra entonces la capacidad de un proceso para ocurrir o no de forma espontánea. Lo influencian dos factores (¿Sólo dos? Si, sólo dos): la energía del sistema (todo sistema tiene una energía asociada) y el nivel de desorden del sistema. Sólo eso, nada más. Si un proceso reduce la cantidad de energía disponible y se desordena, JÚRELO que ese proceso es espontáneo. ¡Póngale la firma! – dijo Rodolfo Piza. La energía que un proceso libera o absorbe se representa con el símbolo ΔH. El orden o desorden que un proceso causa se representa con el símbolo ΔS. Por tanto, como nos gustan las ecuaciones, la Energía Libre de Gibbs se representa así

Bien, con esto en mente y con el conocimiento de que la energía no se crea ni se destruye, solo se transforma, ¿De dónde sale la energía para llevar a cabo la disolución de la sal en el agua? ¿De dónde viene esa capacidad energética, el ΔG? ¿La sal al disolverse, se desordena? ¡Pues si, pasa de un cristal ordenadito a un montón de iones bailando en el agua! ¿Y la energía del proceso de dónde sale? Pues de las mismísimas moléculas del agua y de los enlaces iónicos entre el ión sodio y el ión cloruro. ¡De las fuerzas intermoleculares! ¿Por qué creen que empecé hablando de eso al inicio de esta entrada? Y voy a volver hablar de ellas en otro momento. Volvamos a la sal y la disolución en agua. Un sencillo dibujo de dos dimensiones nos ayuda.
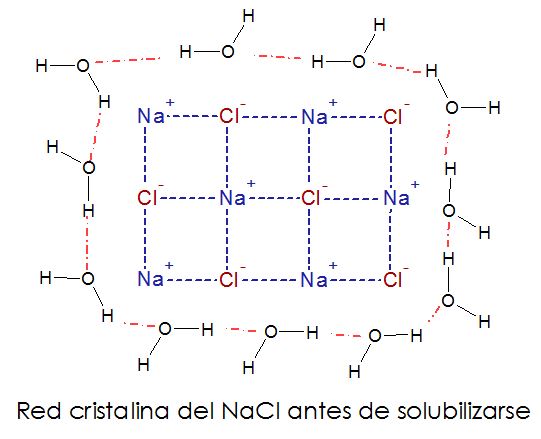
Al principio, los iones sodio y cloruro están unidos por interacciones electrostáticas, es decir, porque negativo atrae a positivo. Esos carajos se cuadran. Y por otro lado, las moléculas de agua están interactuando entre sí por los puentes de hidrógeno los cuales son dipolos especiales donde los pares de electrones libres que tienen carga negativa se sienten atraídos por la carga positiva del núcleo expuesto del hidrógeno de una molécula de agua adyacente. Este fenómeno lo explico aquí. Hasta aquí, todo bien. Para disolver la sal podemos ver esto como que primero hay que separar los iones sodio y los iones cloruro.
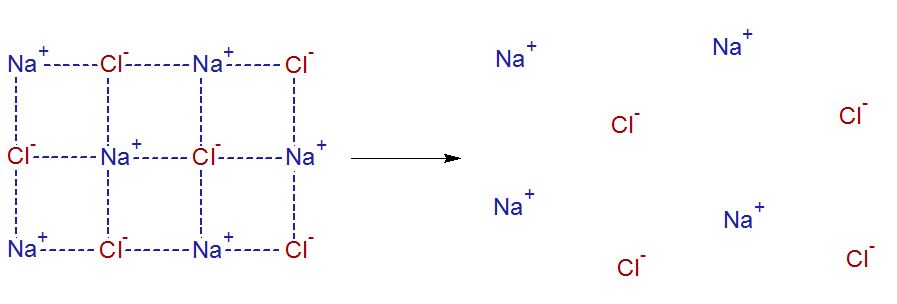
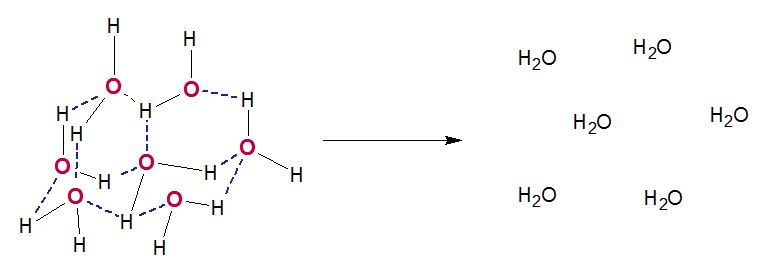
Luego toca separar las moléculas de agua, donde ya sus puentes de hidrógeno no interactúan.
Y luego, tenemos que unir las moléculas de agua con los iones sodio y cloruro que están separados. Algo como así.
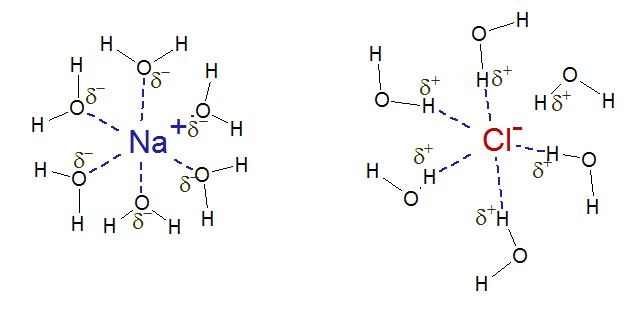
¡Y ya está! Jaja, no mentira, no lo vamos a dejar ahí. Es que ya tengo sueño. Pero no, vamos a terminar esto antes. Separar iones y separar moléculas de agua requiere energía. La energía para separar los iones de su cristal es la misma energía que libera cuando los iones forman el cristal sólido a partir de los iones en estado gaseoso, a esta energía se le llama energía de red cristalina. Esta energía en el caso del NaCl es de 787 kJ/mol. Por otro lado, separar el agua de su estado líquido a su estado gaseoso requiere 40,65 kJ/mol (la cual es la energía de vaporización del agua). «So far, so good» decía mi profesor. De nuevo, despacio y con buena letra. Separo los iones de NaCl: 787 kJ/mol. Separo las moléculas de agua: 40,65 kJ/mol. Cuando separo cosas, invierto energía. Cuando uno cosas obtengo energía. Ese es el mantra.
Entonces, ahora, toca unir las moléculas de agua con los iones correspondientes y como tenemos agua en exceso, toca unir agua con agua. La energía que libera el agua cuando hidrata el ión sodio es de 416 kJ/mol y cuando las moléculas de agua se coordinan con el ión cloruro liberan 365 kJ/mol. Cuando las moléculas de agua se unen a otras moléculas de agua liberan 40,65 kJ/mol. Para saber cuanta energía nos da esto, solo toca sumar. De nuevo, ya sé, soy medio necio: Si separo cosas = añado energía. Si enlazo cosas = retiro energía. Cuando añado energía el signo de la energía es positivo (+), cuando retiro energía el signo de la energía es negativo (-). Ahora si, sumemos
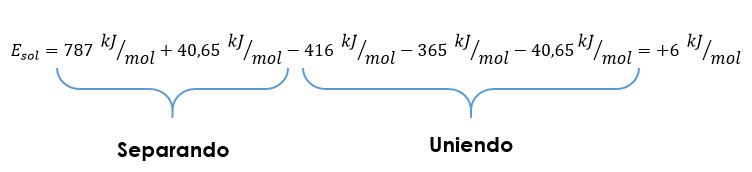
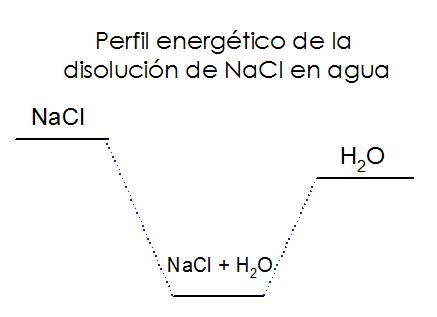
Quiere decir que cuando la sal se disuelve en agua absorbe 18 kJ/mol de energía. Pero, suave, ¿Eso no significa que si disuelvo sal en agua debería de sentir que el recipiente se enfría? ¡Exacto! De hecho, eso es precisamente lo que ocurre, si se fijan, cuando disuelven sal en agua, la temperatura de la disolución disminuye un poco y en días muy fríos, un poco de agua se puede condensar en las paredes externas del recipiente pues esa energía el sistema la toma del ambiente, de los alrededores. Es por eso también que si calientan el agua solubilizan la sal con más facilidad. ¡Carajo!
¡Momentito! Pero… Pero… ¿Entonces eso no haría el sistema NO ESPONTÁNEO? Digo, estamos NECESITANDO energía para que la sal se mantenga disuelta en el agua. No, no; lo que estamos empleando es UNA FORMA de energía: calor; pero el sistema como tal, desde el punto de vista de Energía Libre de Gibbs todavía le falta considerar algo: el desorden; o como le llamamos en ciencia, la entropía. La entropía es una medida del desorden del sistema y a la naturaleza le fascina el desorden. El cambio en el desorden se escribe ΔS, como les comenté en un párrafo anterior, así que analicemos: cuando disolvemos la sal en agua, ¿Aumenta el desorden o disminuye? Respuesta: Aumenta. Como dije, pasamos de un cristal muy ordenado, a los iones bailando desordenadamente en el agua. Por tanto, el cambio en el desorden es positivo.
A ver, si, cálculos. Para una disolución ideal, se puede calcular la entropía de disolución usando unas cuantas fórmulas. Usemos esta y calculamos para 1 mol de cloruro de sodio.

Entonces, aplicando esta ecuación y ajustando para la escala de 1 mol de cloruro de sodio disuelto en una proporción al 5% tenemos que el cambio en entropía es de 0,040 kJ/mol. Al sustituir esto en la ecuación de la Energía Libre de Gibbs asumiendo 298 K de temperatura ambiente

Tenemos que el ΔG de disolución es de – 4 kJ/mol. Ojo, tiene signo negativo entonces el proceso es espontáneo, la sal se va a disolver espontáneamente en el agua.
Si, yo sé que deben de estar frunciendo el ceño sin entender que son todos esos términos. Esos términos vienen de una disciplina llamada termodinámica y estudia a la energía y las reglas para su uso. Por el momento, de entrada, el uso de la energía depende de dos variables únicamente como expusimos antes: ΔH, que se refiere a la cantidad de energía que libera o absorbe un proceso y ΔS, que se refiere a la cantidad de desorden que genera o disminuye un proceso. Ya tendremos muuuuucho tiempo para hablar de esto.
Recapitulando: la sal se disuelve en agua porque las fuerzas intermoleculares del agua y la sal interactúan para poder separar los iones del cloruro de sodio, al mismo tiempo, se aumenta el desorden del sistema favoreciendo aún más la disolución del sólido.
Para entender mejor el enlace iónico pueden leer esta entrada y para leer sobre la Ley de Coulomb puede ver esta otra entrada.
¿Y cuándo las cosas no se disuelven? ¿Qué es lo que pasa? Hablaremos de eso en la siguiente entrada.
¡Que el legado continúe!
LEHP
Referencias
- Explicación de mecanismo de solubilidad. Consultado 27 de abril, 2017
- Energías de solvatación. Consultado 28 de abril, 2017.
- Atkins, P. W. Química Física, 6ta Edición, Ediciones Omega, Barcelona, 1999.


3 comentarios sobre “Solubilidad: Desaparición de Un Sólido en el Agua – Fuerzas Entre las Moléculas: Parte 3”