Autor: Luis Eduardo Hernández
Tiempo de lectura: 9 mins
¿No se han preguntado nunca por qué el azúcar es sólida a temperatura ambiente pero el aceite de soya es líquido? ¿Por qué el propano con que cocinamos es un gas pero el agua, que tiene menor masa molar que el propano es un líquido a temperatura ambiente? Bueno, eso tiene que ver con la fuerza. Usa la fuerza, Luke.
Definamos primero dos conceptos: Fuerzas intermoleculares y fuerzas intramoleculares. Las fuerzas intermoleculares son aquellas ENTRE molécula y molécula, es como interactúan una molécula y su vecina. Las fuerzas intramoleculares son las fuerzas DENTRO de la misma molécula, por lo general, al hablar de fuerzas intramoleculares nos referimos a los enlaces que la molécula tiene.
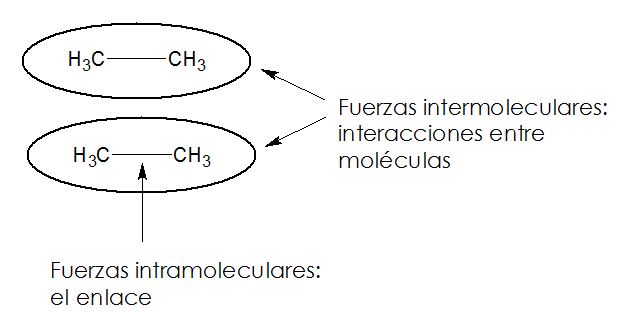
Todas las sustancias tienen características físicas que pueden servir para identificarlas. Así como las características físicas de una persona nos ayuda a identificarlas: color de ojos, estatura, color de piel, olor del perfume, etc. Así también ciertas características de las sustancias químicas nos sirven para identificarlas dentro de estas características podemos citar algunas:
Características Físicas
- Punto de fusión
- Punto de ebullición
- Solubilidad en agua
- Densidad
- Coeficiente de partición agua-octanol
- Índice de refracción
- Patrón de difracción de rayos X (caso de sólidos cristalinos)
- Espectro infrarrojo
- Espectro de resonancia magnética nuclear
- Espectro ultravioleta
- Rotación de luz polarizada
Estas características físicas son una expresión macroscópica de algo que tiene sus raíces en el campo atómico y molecular: la estructura de las sustancias. La estructura de una sustancia define sus propiedades físicas. Conociendo la estructura podemos predecir tendencias en las características físicas de una sustancia como su punto de ebullición o su solubilidad. La estructura de una sustancia define el comportamiento de las fuerzas intermoleculares de dicha sustancia y son estas, las fuerzas intermoleculares, las que definen algunas constantes físicas como el punto de ebullición, punto de fusión y solubilidad. Ojo la referencia (2), ahí pueden descargar un interesante artículo al respecto.

Para poder entender mejor la forma de las moléculas y poder identificar la dirección de los dipolos y las interacciones intermoleculares lo mejor es recurrir a un modelo molecular. Lo más práctico es que le den click en este enlace de Amazon España en este enlace o en este de Amazón Estados Unidos en este otro enlace.
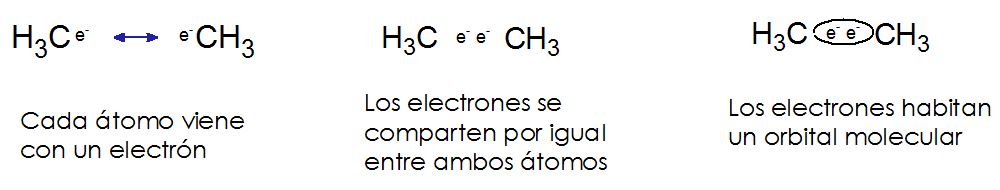
Las sustancias se podrían clasificar en dos tipos diferentes en función del tipo de fuerzas intramoleculares (entre átomo y átomo, a nivel de enlaces) que intervienen en las mismas: sustancias covalentes y sustancias iónicas. Un enlace covalente es aquel en el que los electrones se comparten por igual entre los átomos involucrados en el enlace.
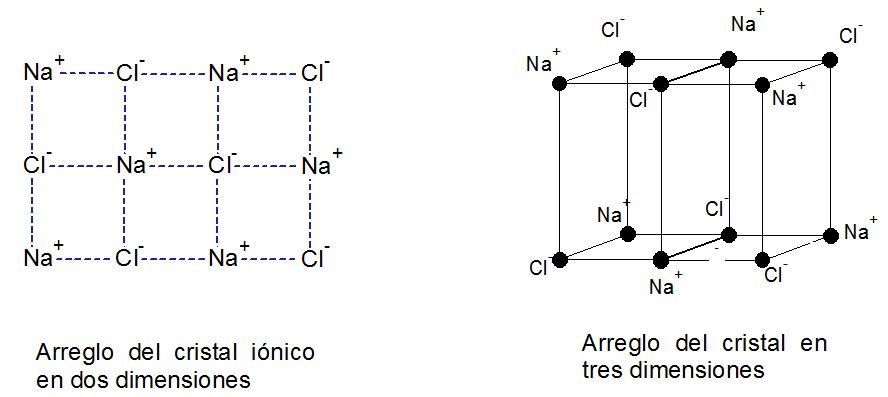
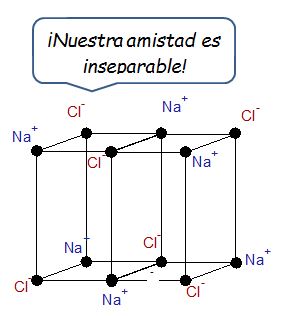
Los enlaces iónicos, por otro lado, se caracterizan porque existe una separación de cargas definida en la que un elemento no metal con mucha afinidad por los electrones le roba un electrón a un elemento metálico. Por tanto, uno de los átomos queda con una carga negativa y otro con carga positiva generando una interacción intermolecular en la que la fuerza de coulomb prevalece. Los iones van formando un cristal en el que los átomos se acomodan optimizando las interacciones de coulomb. Para el caso del NaCl, cloruro de sodio, el arreglo del cristal ocurre en una forma simple tal y como se muestra en la figura. ¿No es una belleza?
Las sustancia iónicas (conocidas en términos generales como sales) tienen la mayor de las fuerzas intermoleculares ya que estas sustancias se componen de cargas positivas y negativas que se atraen con mucha fuerza. Las cargas siguen la relación matemática siguiente para la fuerza entre las mismas.
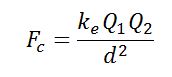
Donde ke es la constante coulómbica que depende del medio, Q1 y Q2 son las cargas y d es la distancia entre las cargas. Esta es la Ley de Coulomb. Así pues, las fuerzas entre iones son bastante fuertes y por esta razón los puntos de fusión y ebullición son bastante altos siendo las sales un sólido a temperatura ambiente. Pueden revisar esta entrada para saber más del enlace iónico.
Las sustancias orgánicas, las cuales tienen enlaces covalentes, ya que están formadas por elementos no metálicos como lo son el carbono, hidrógeno, oxígeno y nitrógeno entre otros, están compuestas de moléculas, no de iones, tienen puntos de ebullición y fusión más bajos que las sales. Estas moléculas interaccionan con otras moléculas haciendo uso de las características de los enlaces covalentes que las componen. Las moléculas pueden tener dos tipos de enlaces covalentes
- Enlaces covalentes no polares
- Enlaces covalentes polares
Los enlaces covalentes no polares se dan cuando los átomos involucrados en el enlace tienen la misma afinidad (o muy parecida) por los electrones. Así, los electrones en el enlace no prefieren estar con uno u otro átomo en particular sino que quedan distribuidos simétricamente a lo largo del enlace. Es un enlace socialista en que todo se comparte en partes iguales. (2)
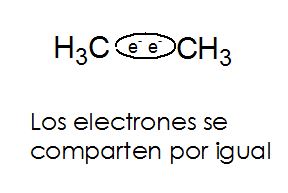
Sin embargo, cuando el enlace covalente se da entre dos elementos diferentes donde uno de los elementos tiene más afinidad por los electrones, los electrones no se comparten por igual, el elemento con más afinidad por ellos, los atrae con más fuerza hacia sí provocando que se de una separación de cargas en el enlace. El átomo del elemento menos afín queda ahora con un ligero desbalance de carga mostrando un polo positivo, mientras que el átomo del elemento más afín a los electrones queda con un polo negativo. A esto se le llama un enlace polar.

A la capacidad de un elemento de presentar afinidad por los electrones se le llama electronegatividad. Es como una medida de que tan desesperado está un elemento por tener electrones. Hablaremos de esa propiedad en otra entrada.
En virtud de estas características en los enlaces covalentes es que tenemos diferentes propiedades físicas. Por ejemplo, por lo general, las sustancias iónicas tienen puntos de fusión muy altos, una gran parte de ellos son solubles en agua pero insolubles en solventes orgánicos. En la práctica, la energía para romper las fuerzas iónicas o las interacciones intermoleculares entre enlaces covalente polares o no polares se transmite como calor el cual se detecta como temperatura, entre más calor se necesite para romper las fuerzas intermoleculares, mayor su temperatura, por tanto, mayor su punto de ebullición y fusión. (2)
Bien, entonces, los enlaces polares, ¿Cómo afectan el punto de ebullición y fusión de las sustancias? Pues veamos primero un enlace polar. Como dijimos, el enlace polar se da cuando el enlace ocurre entre dos átomos con electronegatividad muy diferente. El átomo con mayor electronegatividad acercará hacia él los electrones del enlace creando un desbalance de carga. Ojo, no se rompe el enlace, el enlace sigue siendo covalente, solo que los electrones están más hacia el átomo electronegativo. El desbalance de carga se representa con la letra griega δ y se le coloca un signo (-) si es del lado del átomo más electronegativo o un signo (+) si estamos mostrando el lado del átomo menos electronegativo. Tomemos de ejemplo la acetona, la cual tiene en el oxígeno un átomo electronegativo. Cuando las moléculas de acetona están en estado líquido, estas se acomodan de forma que la parte negativa del dipolo interactúe con la parte positiva del dipolo de la molécula adyacente.
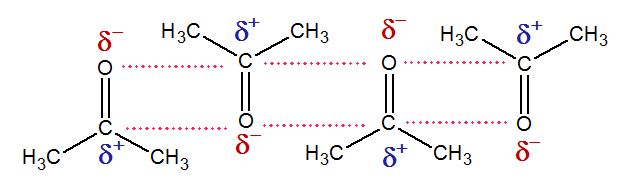
Aunque no son cargas puntuales definidas como en el caso de los iones, estas fuerzas suman lo suficiente para hacer que la sustancia sea líquida a temperatura ambiente. Cuando se calienta la acetona para hacerla ebullir, la energía proveniente del calentamiento se usa para darle energía cinética a cada molécula de acetona que empieza a moverse con mucha mayor velocidad al punto que tiene tanta velocidad que logra vencer las fuerzas del dipolo y entonces escapa a la fase gaseosa.
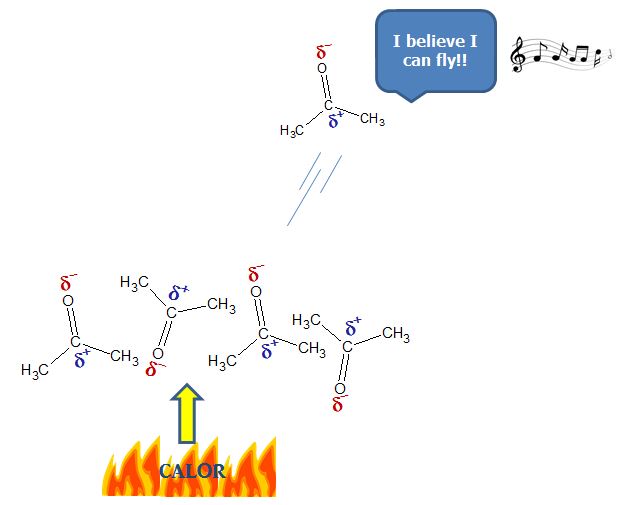
Esto para el caso de las moléculas polares, en el caso de las moléculas no polares en la que los enlaces de las moléculas están hechas con átomos de la misma electronegatividad o muy parecida, las fuerzas que intervienen cuando las moléculas no polares están aglomeradas son las llamadas fuerzas de Van der Waals. A muy bajas temperaturas, las moléculas tienen muy poca energía cinética, es decir, tienen muy poca velocidad. Cuando las moléculas tienen poca velocidad, empiezan a interactuar unas con otras haciendo que los electrones presentes en una molécula distorsione los electrones de la molécula adyacente. Esto provoca que los electrones se repelen alejándose hacia un extremo de la molécula causando un desbalance de carga lo cual se manifiesta en un dipolo temporal.
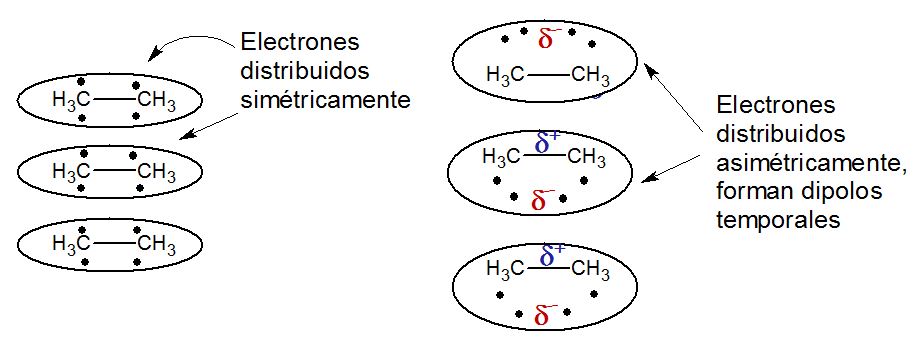
Estos dipolos temporales se atraen y entonces las moléculas se aglomeran pasando del estado gaseoso al estado líquido. Recuerden, esto ocurre a muy bajas temperaturas, por eso, las sustancias no polares tienen por lo general una temperatura de fusión muy baja comparado con las temperaturas de fusión de sustancias polares y iónicas.
Una observación: Las temperaturas de ebullición de una sustancia depende casi que completamente de las fuerzas intermoleculares (dipolo-dipolo o fuerzas de Van der Waals). Sin embargo, en el caso de los puntos de fusión, otro factor entra en juego: el acomodo de las moléculas. Cuando las moléculas están en estado sólido, las mismas tiene poco movimiento y su ubicación en el sólido es importante para así optimizar las fuerzas intermoleculares entre ellas. Una molécula con un sólido muy desordenado tiene poca optimización de las fuerzas intermoleculares haciendo que su punto de fusión sea más alto en comparación con una sustancia que pueda acomodar sus moléculas en un sólido más ordenado. Pero, ¿Cómo puedo, viendo una estructura, predecir si tendrá un punto de fusión más alto que otra molécula? Fácil. Fíjense en la simetría de la molécula, entre más simétrica la molécula, mejor se puede acomodar en un cristal, mayor su punto de fusión.
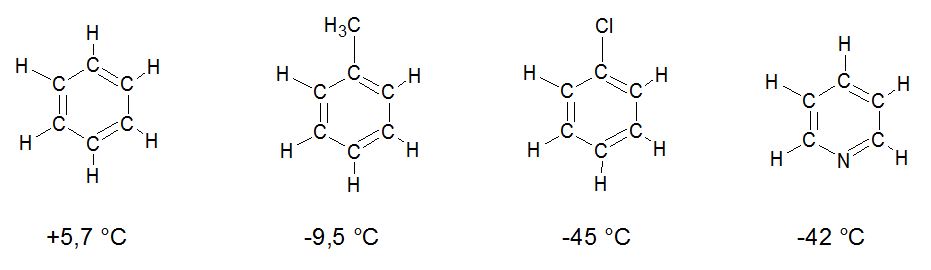
Es claro que al disminuir la simetría, los puntos de fusión bajan. Esto es especialmente cierto cuando no hay fuerzas intermoleculares fuertes como dipolos. Esta observación fue hecha por Carnelley en 1882 después de medir el punto de fusión de 15 000 sustancias. Cuando tenemos sustancias con fuerzas intermoleculares fuertes como los dipolos, entonces los puntos de fusión son mucho más altos pero la contribución de la simetría molecular sigue siendo igual de importante. Por tanto, entre más fuerzas intermoleculares hayan, mayor el punto de fusión y entre más simetría tenga una molécula, mayor su punto de fusión. Si tenemos ambos componentes, el punto de fusión puede llegar a ser bastante alto en comparación con otras moléculas con masa molar parecida. De nuevo, punto de fusión depende de las fuerzas intermoleculares y del acomodo del sólido. Si una molécula es muy simétrica, optimiza el acomodo de las moléculas en el sólido. Hay otras interacciones que debemos mencionar pero lo dejaremos para otra entrada.
El punto de fusión y ebullición de una sustancia pueden ser determinados por varios métodos sencillos. Uno de los más modernos y sofisticados consiste en el uso del aparato Mel-Temp® el cual mediante un calentador electrónico, un termómetro digital y una lente de magnificación puede medirse el punto de fusión o ebullición de una sustancia con una muy pequeña cantidad de muestra. Por lo general, el aparato Mel-Temp® tiene un regulador de voltaje con el cual se puede regular la temperatura y la velocidad con la que el aparato aumenta dicha temperatura. Hay otras versiones que usan un termómetro de mercurio (mis favoritos) el cual tiene el bulbo a la misma temperatura que las muestras. Es un aparato muy útil y conveniente.
Otro método para la determinación del punto de fusión y ebullición es el uso del tubo de Thiele el cual usa un líquido con un alto punto de ebullición, por lo general glicerina y un mechero Bunsen. Se coloca la muestra sujeta a un termómetro de mercurio y se pone a calentar el líquido viscoso dentro del tubo de Thiele de manera constante, se va registrando el aumento de la temperatura en el termómetro y cuando se da la evidencia del cambio de fase en la sustancia, se anota la temperatura. Este es un método arcaico pero muy útil. ¡Es como emular a Antoine Lavoisier!
Otro método para la medición del punto de fusión en el laboratorio es el uso del aparato Fisher-Johns el cual usa un disco caliente que aumenta la temperatura gradualmente. Se coloca la muestra en un portaobjetos y se cubre con un cubreobjetos, ambos de forma redonda, se coloca esta muestra sobre el disco y se sube la temperatura. En el momento que se detecta el cambio de fase, se registra la temperatura en el termómetro. Fácil.

Aparato Fisher-Johns para medir punto de fusión
Yo sé, esta no es la más fascinante de las entradas al blog sobretodo siendo de química orgánica… Pero, ¿Cierto o no que fue útil?
Hablaré de solubilidad en otra entrada en la cual profundizaremos en un tipo de fuerza entre moléculas del tipo dipolo – dipolo pero que tiene características particulares: el puente de hidrógeno. Para continuar con la 2da parte, den click aquí. Y si quieren leer la 3a parte, pues den click aquí.
Sin más, ¡Que el legado continúe!
Práctica
Para unos ejercicios de práctica para efectos de examen y otros, den click aquí.
LEHP
Referencias
- Zubrick, J. The Organic Chem Lab Survival Manual. 5ta Edición, John Wiley & Sons, New York, 2001.
- Prhalada, R.; Sunkada, S. Making Sense of Boiling Points and Melting Points. Resonance, 2007, 43 – 57
- Pavia, D.; Lampman, G.; Kriz, G.; Engel, R. Organic Laboratory Techniques: A Microscale Approach. Saunders College Publishing, New York, 1990.
Creación de Contenido Digital
Si está interesado en agregar contenido digital de corte científico verificable como parte de su estrategia de comunicación digital a través de su página, blog o redes sociales, lo invitamos a comunicarse con nostros haciendo click aquí.




El Caso del Terminator T-1000 y Por Qué Es Imposible Que Exista:
http://www.unquimico.com/2011/03/un-terminator-de-metal-liquido/
Me gustaMe gusta
Si comparo entre moléculas cual tiene mayor punto de fusión. Es correcto que a mayor peso molecular mayor el punto de fusión
Me gustaLe gusta a 1 persona
Hola Isaac. En cuanto a punto de fusión, es más importante la simetría de las moléculas. Por ejemplo, benceno tiene mucha simetría y masa molar de 78 g/mol y su P. Fus es 5,5 °C. Un alto punto de fusión comparado con 2,3-dimetilhexano de masa molar 114 g/mol pero poca simetría molecular por lo que su punto de fusión es bajo (-110 °C). La simetría de la molécula es importante pues cuando forma el cristal sólido, entre más simétrica una molécula, mejor se empaqueta el cristal y optimiza las interacciones intermoleculares.
Me gustaMe gusta
hola… esto no es contradictorio???
Una molécula con un sólido muy desordenado (…..) su punto de fusión sea más alto en comparación con una sustancia que pueda acomodar sus moléculas en un sólido más ordenado. (….) entre más simétrica la molécula, mejor se puede acomodar en un cristal, mayor su punto de fusión.
Un saludo
Me gustaMe gusta
Hola Ana, aquì contestando. Correcto. Tal vez mi redacción no fue clara pero en efecto, entre menos simetría tenga una molécula, sus puntos de fusión serán más bajos (requiere menos energía para pasar del estado sólido al líquido). En esta línea lo comento tal como lo dices: «Fíjense en la simetría de la molécula, entre más simétrica la molécula, mejor se puede acomodar en un cristal, mayor su punto de fusión.»
Me gustaMe gusta
Quisiera saber su apellido para poder citar está información
Me gustaMe gusta
Hola, mi apellido es Hernández
Me gustaMe gusta